Microprobes神经电极皮质输入至背外侧纹状体中突触前钙瞬变被代谢型GABAB和mGlu2/3受体抑制
一、简介
感觉运动或背外侧纹状体(DLS)是皮质-基底神经节环路中的关键节点,该环路介导动作选择、技能学习和习惯形成。皮质到DLS的输入驱动内在静息的纹状体输出神经元(即中等棘神经元)的活动。这些皮质输入在技能学习和习惯形成过程中受到动态调节,而在以动作控制受损为特征的疾病(包括物质滥用、强迫症、亨廷顿病和帕金森病)中则出现调节异常。因此,调节皮质纹状体传递的时间和效能的细胞过程是DLS相关环路功能、行为和病理的关键决定因素。
DLS中皮质纹状体传递的两个重要调节因子是突触前抑制性Gi/o G蛋白偶联受体(GPCRs)——GABAB和II组代谢型谷氨酸(mGlu2/3)受体。从中等棘神经元和纹状体内神经元(尤其是神经胶质样中间神经元)的回返 collateral释放的GABA激活皮质纹状体末端的GABAB受体,以抑制谷氨酸释放。mGlu2/3受体突触周表达于皮质纹状体末端,作为自身受体,在显著活动期后对DLS中的谷氨酸释放起负调节作用。
GABAB和mGlu2/3受体可通过抑制腺苷酸环化酶活性和cAMP积累、抑制电压门控钙(Ca²⁺)通道(VGCCs)和/或抑制突触前Ca²⁺内流下游的囊泡释放机制成分来减少突触传递。然而,这些受体调节DLS中皮质纹状体末端谷氨酸释放的途径仍不清楚。有研究发现,功能性突触前Q型VGCCs对于GABAB受体激活后所见的背侧纹状体群体峰电位的双脉冲比率(PPRs)增加是必需的。然而,缺乏GABAB受体介导的对皮质纹状体输入中突触前Ca²⁺影响的直接证据。同样,尽管有证据表明背侧纹状体中存在丝裂原活化蛋白激酶依赖性、cAMP/蛋白激酶A非依赖性的mGlu2/3受体介导的抑制机制,但突触前Ca²⁺在这种抑制中的明确作用尚未确立。事实上,早期使用皮质纹状体共培养制备的研究表明,mGlu2/3受体可抑制VGCCs下游的谷氨酸释放,因为mGlu2/3受体激活降低了独立于VGCC功能的微型兴奋性突触后电流的频率。
为了阐明突触前Ca²⁺在GABAB和mGlu2/3受体对皮质纹状体传递的调节作用中的角色,我们开发了一种新方法,利用基因编码的Ca²⁺指示剂GCaMP6s和脑片光度法来评估DLS中皮质纹状体输入群体的突触前Ca²⁺。我们提供直接证据表明,GABAB和mGlu2/3受体均抑制皮质纹状体传入纤维中刺激诱发的突触前Ca²⁺瞬变(PreCaTs),并且功能性P/Q型VGCCs是皮质纹状体mGlu2/3受体正常抑制作用所必需的。在大多数情况下,诱发的PreCaTs变化与通过同步场电位记录测量的DLS输出变化平行,表明突触前Ca²⁺的抑制可能有助于这些受体对突触传递的抑制。然而,观察到这两种测量之间存在一些不一致,在此背景下,我们讨论了光度法技术的优势和局限性。
二、方法
01. 伦理批准
所有程序均符合美国国立卫生研究院《实验动物护理和使用指南》,并经相关机构动物护理和使用委员会批准。
02. 动物
使用在Emx1启动子控制下表达内部核糖体进入位点Cre重组酶基因的雄性和雌性Emx1Cre小鼠。Emx1Cre小鼠与C57BL/6 J回交超过八代,并繁殖为Emx1Cre等位基因杂合子。为了评估中枢Cre表达,将Emx1Cre小鼠与在增强型绿色荧光蛋白(EGFP)变体ZsGreen1上游表达loxP侧翼STOP序列的小鼠杂交。所有小鼠以2-4只为一组饲养,置于12小时光照周期(06:30开灯)下,自由进食和饮水。
03. 病毒载体
从相关机构购买编码GCaMP6s双 floxed 反向开放阅读框构建体的腺相关病毒(AAV)载体(相关型号;约213 GC ml⁻¹)和EGFP(相关型号;约213 GC ml⁻¹)。
04. 手术
在异氟烷麻醉下,对Emx1Cre小鼠(出生后30-40天)进行立体定向手术,将300 nl的AAV-FLEX-GCaMP6s或AAV-FLEX-EGFP双侧注射到M1运动皮层。相对于前囟的M1坐标为(毫米):前后(A/P):+1.1;内外(M/L):±1.7;背腹(D/V):-0.9。手术完成前30分钟皮下注射酮洛芬(5 mg kg⁻¹)。手术后5-8周,取出大脑进行切片记录。
05. 脑片制备
对出生后70-90天的小鼠进行异氟烷麻醉,取出大脑,使用振动切片机在含 carbogen 饱和的4°C切割溶液中制备350 μm厚的包含纹状体的冠状切片,切割溶液成分(mM):194蔗糖,30 NaCl,4.5 KCl,1 MgCl₂,26 NaHCO₃,1.2 NaH₂PO₄和10 d-葡萄糖。切片在33°C的 carbogen 饱和人工脑脊液(aCSF)中平衡30分钟,aCSF成分(mM):124 NaCl,4.5 KCl,1 MgCl₂,2 CaCl₂,26 NaHCO₃,1.2 NaH₂PO₄和10 d-葡萄糖。然后将切片在23-24°C的aCSF中孵育,直至作为半切片转移到记录室。
06. 光度法和细胞外场记录
在23-24°C下,从表达GCaMP6s或EGFP的脑片中获取光度法和细胞外场记录,脑片在浸没室中以2 ml min⁻¹的速度灌注aCSF。类似于相关研究人员最近使用的方法,荧光团通过汞灯(相关规格汞灯,相关供应商,35%强度)发出的470±20 nm光激发,通过正置显微镜上的40×0.8 NA水浸物镜传输。来自DLS内180 μm²区域(在350 μm厚的切片中)的落射荧光在525±25 nm处过滤,并导向光电倍增管(PMT;相关型号)。PMT电压输出(时间常数:5 ms;增益:400×10⁻¹ μA V⁻¹)在1 kHz处低通滤波,并使用相关软件和设备以6.67 kHz数字化。PMT输出的幅度代表每个时间点的总光子计数。通过相关软件控制快门驱动器和快门,将切片照射限制为每30秒4秒间隔。在每个4秒照射间隔的第2秒,通过放置在DLS与其上方白质边界、所选180 μm²区域边缘的同心双极钨刺激电极(WE3CEA5,Microprobes公司,美国马里兰州盖瑟斯堡)传递电脉冲(0.5-0.8 mA,40-100 μs)。这种刺激引发诱发的PreCaTs(与PMT检测到的光子增加成比例)和诱发的细胞外场群体峰电位(PSs),后者通过放置在DLS内的含0.9% NaCl溶液的薄壁玻璃记录电极(2-5 MΩ)检测。细胞外场电位被放大(×1000;相关型号数字放大器),分别在1和3 kHz处进行高通和低通滤波,并以6.67 kHz数字化(相关设备和软件)。PreCaTs和细胞外场电位同时或分别记录(每个实验中≥25%为同时记录)。
选择GCaMP6s而非其他变体(GCaMP6m或6f)是为了优化诱发的PreCaTs的信噪比(SNR)。DLS中180 μm²的光学记录区域是根据我们实验室之前的研究和旨在优化PreCaT SNR的初步研究确定的。当光学记录区域包含密集的弯曲GCaMP6s表达突触前元件时,PreCaTs最强(图1E)。避免选择穿过纹状体的GCaMP6s表达纤维束(如图1D中背内侧纹状体所示),因为它们对电刺激无反应,可能缺乏使活动依赖性Ca²⁺内流成为可能的VGCCs。在470 nm光照4秒和单脉冲电刺激(均每30秒发生一次)的20-30分钟期间后,基线荧光和诱发的PreCaT幅度稳定。在此稳定期后开始PreCaT和场电位记录。

图1. 背外侧纹状体皮质纹状体输入中的GCaMP6s表达
A, AAV-FLEX-GCaMP6s构建体示意图。在Cre重组酶存在的情况下,两对loxP和lox2272位点的重组使GCaMP6序列相对于其启动子CAG从反义方向变为有义方向。B, 向M1注射AAV-FLEX-GCaMP6s的示意图。C, 在相关小鼠的含纹状体冠状脑切片中,Cre介导的EGFP优先在皮质锥体细胞(和皮质神经胶质细胞)中表达。D和E, 向相关小鼠M1注射AAV-FLEX-GCaMP6s后,M1皮质锥体细胞(D)和DLS中的突触前皮质纹状体元件(D, E)中Cre介导的GCaMP6s表达。E中所示区域由D中的方框指示。F, 脑片光度法和电生理记录示意图。放置在DLS与其上方白质边界的同心双极刺激电极诱发纹状体荧光瞬变(由光电倍增管(PMT)检测)和纹状体场电位(由玻璃记录电极检测)。G, 注射AAV-FLEX-GCaMP6s或AAV-FLEX-EGFP的相关小鼠DLS中,100 μs电脉冲诱发的荧光和场电位的电流-反应曲线。注射GCaMP6s的小鼠(绿色圆圈,n=6)显示诱发的荧光瞬变随刺激电流幅度和群体峰电位(PS)幅度(橙色三角形,n=6)变化(右侧轨迹;每个电流幅度的四个诱发反应平均值),而注射EGFP的小鼠(灰色正方形,n=6)则无。荧光图像比例尺:500 μm(C, D),200 μm(E)。注射AAV-FLEX-GCaMP6s的相关小鼠诱发的PreCaTs比例尺:1% ΔF/F,0.5 s(G)。
07. 分析
在相关软件中以2分钟为单位(四次轨迹)对光度记录进行平均,并导出到相关软件和Microsoft Excel进行处理。对每个平均轨迹拟合指数衰减(不包括对应诱发PreCaT的时期),并用于线性化和减去基础光度记录(类似于相关研究)。PreCaT幅度测量为刺激诱发荧光瞬变的平均峰值幅度与刺激前即刻测量的平均荧光的比率,然后转换为百分比(% ΔF/F)。在实验操作中检查PreCaT幅度时程的实验中,幅度表示为每个切片基线记录期间获得的平均幅度的百分比。

东莞市富临塑胶原料有限公司是 Microprobes 在中国的代理商,富临塑胶为中国客户提供 金属微电极、多通道阵列、外周电极和技术协助。
幅度<0.6% ∆F/F(稳定后)的单脉冲诱发PreCaTs被排除,以避免药物应用后信噪比不足。约85%注射GCaMP6s的相关小鼠至少有一个脑片在DLS中具有足够的皮质纹状体GCaMP6s表达,可诱发≥0.6% ∆F/F的PreCaT幅度。
为计算PreCaT幅度的PPR,对每个脉冲间隔(IPI)诱发四个单脉冲轨迹和四个双脉冲轨迹组。对每个四轨迹组进行平均,并使用上述指数衰减对平均值的基础基线进行线性化和减去。从每个相关的PPR中减去平均单脉冲响应,以分离对双脉冲中第二个脉冲的响应。第二个脉冲的峰值∆F/F与相关单脉冲的峰值∆F/F的比率被视为PreCaT PPR。
在相关软件中测量单个轨迹的平均PS幅度(定义为伪迹后峰值阳性与后续峰值阴性之间的电压差),并在相关软件中进行分析。在实验操作中检查PS幅度时程的实验中,PS幅度以2分钟为单位平均,并表示为每个切片基线记录期间获得的平均幅度的百分比。
所有单脉冲诱发的PreCaT和PS幅度比较均根据情况使用双尾、配对或未配对Students t检验。除非另有说明,上述特定时间点的2分钟数据组用于这些比较。基线比较使用t=6分钟的2分钟数据组。使用双因素重复测量方差分析(ANOVA)和事后比较分析PPR,其中内因子为IPI,间因子为药物处理。
08. 药物
TTX、2,3-二羟基-6-硝基-7-磺酰氨基苯并(f)-喹喔啉(NBQX)、dl-2-氨基-5-膦酰基戊酸(AP5)、ω-芋螺毒素GVIA、ω-aga毒素IVA和LY379268在蒸馏水中制备。巴氯芬在0.5%乙酸中制备。CGP55845、LY341495、硝苯地平和ryanodine在DMSO中制备。所有药物在aCSF中稀释至最终浓度(最终DMSO浓度≤0.1%)。
09. 免疫组织化学
在深度异氟烷麻醉下,对相关小鼠经心灌注0.1 M PBS和4%甲醛-PBS溶液(pH 7.4)。收集大脑并在4°C下于4%甲醛中后固定24小时。使用振动切片机在额叶皮层和纹状体处制作50 μm厚的冠状切片。在旋转平台上,切片在含0.2% Triton X-100的PBS中孵育2小时,在含5% BSA的上述溶液中封闭4小时,并在含0.2% Triton X-100的PBS中于4°C下用鸡多克隆抗GFP抗体(1:2000)孵育12小时。经三次1小时洗涤后,切片在含0.2% Triton X-100的PBS中于4°C下用Alexa Fluor 488山羊抗鸡抗体(1:2000)孵育12小时。经1小时洗涤和两次1小时PBS洗涤后,使用水性封片剂将切片 mounted在载玻片上,盖上盖玻片,并使用相关软件和设备在显微镜上成像。为呈现效果,每张图像的亮度均一调整。
三、结果
01. DLS中皮质纹状体PreCaTs的表征
为检测皮质纹状体投射突触前元件中的Ca²⁺,我们向相关小鼠M1双侧注射AAV-FLEX-GCaMP6s(图1A),并使用荧光光度法评估局部电刺激在DLS中诱发的PreCaTs(图1F)。将相关小鼠与报告小鼠杂交,显示荧光团在整个皮层中密集表达(图1C)。因此,向相关小鼠M1注射AAV-FLEX-GCaMP6s导致基因编码钙指示剂(GECI)在M1(图1D)和M1投射神经元靶点(包括DLS)中表达,通过直接观察GCaMP6s或对其GFP部分进行免疫染色评估(图1E)。重要的是,在本研究分析的任何切片中,纹状体均未检测到表达GCaMP6s的胞体。在注射AAV-FLEX-GCaMP6s的相关小鼠DLS中检测到随刺激电流幅度和场PS幅度变化的诱发PreCaTs(n=6 GCaMP6s,Field),而注射AAV-FLEX-EGFP的小鼠(n=3;图1G)则未检测到,表明PreCaTs代表皮质纹状体突起中依赖活动的胞质Ca²⁺增加。
我们接下来评估皮质纹状体PreCaTs是否依赖动作电位和Ca²⁺。浴应用钠通道阻滞剂TTX(1 μM,n=4;图2A)和无Ca²⁺ aCSF(n=4;图2B)可消除PreCaTs,应用非特异性VGCC阻滞剂镉(100 μM;在t=60分钟时为基线的10.6±1.9%,n=5)可显著降低PreCaTs。正如预期,这三种处理还以与对PreCaTs的影响相当的速率消除场电位记录中测量的PSs(n=3–5;图2A–C)。与突触前表达位点一致,PreCaTs而非PSs对离子型谷氨酸受体拮抗剂NBQX(10 μM)和AP5(50 μM)的联合应用不敏感(在t=40分钟时为基线的95.2±5.5%,n=7)(图2D)。这些结果表明,PreCaTs反映动作电位依赖性Ca²⁺进入DLS中的突触前皮质纹状体元件。
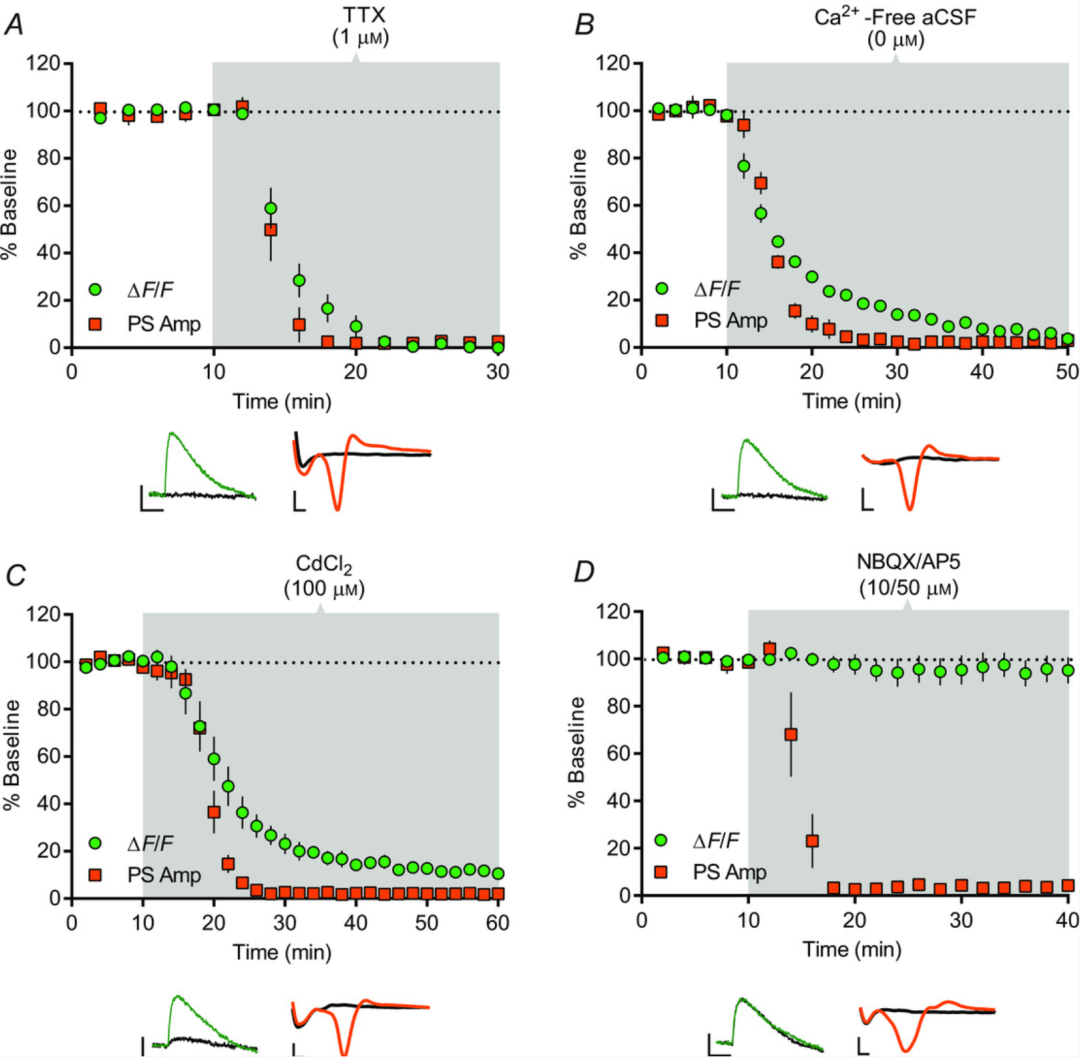
图2. 背外侧纹状体中皮质纹状体PreCaTs的表征
TTX、无Ca²⁺ aCSF、CdCl₂和NBQX/AP5对DLS中电脉冲诱发的光度PreCaT和电生理场电位记录的影响时程。PreCaT幅度表示为基线∆F/F百分比(绿色圆圈),群体峰电位幅度表示为基线PS Amp百分比(橙色正方形)。阴影区域对应药物应用时期。每张图下方显示PreCaT(左,四个诱发反应平均值)和场电位记录(右,八个诱发反应平均值)的代表性轨迹。A, 浴应用钠通道阻滞剂TTX(1 μM)20分钟消除PreCaTs和PSs。B, 浴应用无Ca²⁺ aCSF 40分钟消除PreCaTs和PSs。C, 浴应用非选择性Ca²⁺通道阻滞剂CdCl₂(100 μM)50分钟显著降低PreCaT幅度并消除PSs。D, 浴应用AMPA和NMDA受体拮抗剂NBQX(10 μM)和AP5(50 μM)30分钟对PreCaT幅度无影响,但消除PSs。轨迹时间点:绿色/橙色,10分钟;黑色,70分钟(A),50分钟(B),60分钟(C),40分钟(D)。轨迹比例尺:PreCaTs,1% ΔF/F,0.5 s;场电位,0.5 mV,1 ms。
02. VGCC对皮质纹状体PreCaTs和传递的贡献
使用PreCaT和场电位联合记录,我们接下来测试特定VGCC对DLS中皮质纹状体传递的贡献。应用N型VGCC阻滞剂ω-芋螺毒素GVIA(1 μM)可显著降低PreCaT(在t=70分钟时为基线的67.6±2.2%,n=6)和PS幅度(在t=70分钟时为基线的49.7±7.9%,n=8)(图3A)。P/Q型VGCC阻滞剂ω-aga毒素IVA(200 nM)未引起PreCaT幅度的显著降低(在t=70分钟时为基线的86.4±5.7%,n=6),但观察到PS幅度的显著降低(在t=70分钟时为基线的80.8±8.2%,n=6)(图3B)。联合应用ω-芋螺毒素GVIA(1 μM)和ω-aga毒素IVA(200 nM)导致PreCaT(在t=70分钟时为基线的60.2±8.6%,n=6)和PS幅度(在t=70分钟时为基线的28.6±11.6%,n=5)的相加抑制。相比之下,L型VGCC阻滞剂硝苯地平(1 μM)对PreCaTs(在t=50分钟时为基线的95.6±3.7%,n=6)和PSs(在t=50分钟时为基线的102.1±2.3,n=3)均无影响(图3C)。这些数据共同支持N型VGCC以及在较小程度上P/Q型VGCC在运动皮质纹状体投射中诱发的突触前Ca²⁺内流和DLS兴奋性传递中的作用。
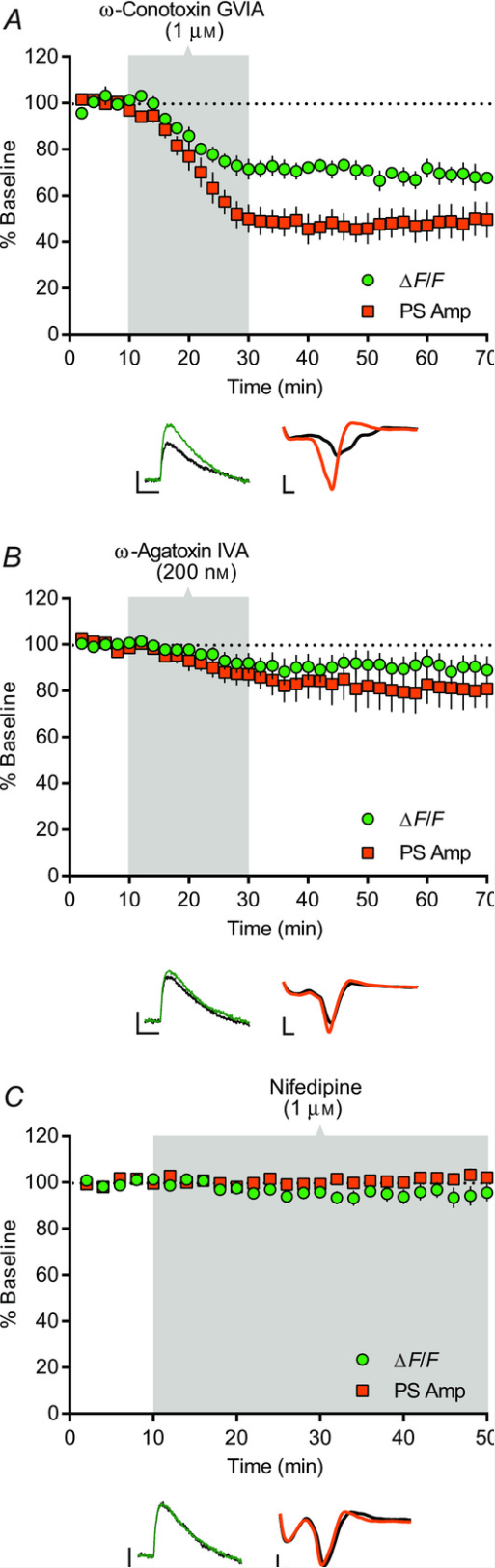
图3. VGCC对皮质纹状体PreCaTs和传递的贡献
ω-芋螺毒素GVIA、ω-aga毒素IVA和硝苯地平对DLS中电脉冲诱发的PreCaT(∆F/F)和场电位(PS Amp)记录的影响时程。阴影区域对应药物应用时期。每张图下方显示PreCaT(左,四个诱发反应平均值)和场电位记录(右,八个诱发反应平均值)的代表性轨迹。A, 浴应用N型VGCC阻滞剂ω-芋螺毒素GVIA(1 μM)20分钟抑制PS幅度。B, 浴应用P/Q型VGCC阻滞剂ω-aga毒素IVA(200 nM)20分钟适度抑制PS幅度。C, 浴应用L型VGCC阻滞剂硝苯地平(1 μM)40分钟对PreCaT或PS幅度无影响。轨迹时间点:绿色/橙色,10分钟;黑色,70分钟(A, B),50分钟(C)。轨迹比例尺:PreCaTs,1% ΔF/F,0.5 s;场电位,0.5 mV,1 ms。
03. 皮质纹状体PreCaTs和传递的PPRs
皮质纹状体突触可对成对传入刺激表现出短期抑制(双脉冲抑制(PPD)),但在第二个刺激时突触前末端的残留Ca²⁺在短IPIs时驱动这些突触趋向双脉冲易化(PPF)。由于无法直接评估这些突触的突触前Ca²⁺,因此无法研究突触前Ca²⁺对这种短期可塑性的贡献机制。因此,我们测量了对间隔10 ms至6 s的双电脉冲响应的皮质纹状体PreCaTs(和PSs)。
我们观察到PreCaT幅度的显著PPF在IPIs为20 ms时达到峰值(2.7±0.2 PreCaT2/PreCaT1,n=7),在IPIs为6 s时不再存在(1.1±0.0)(图4A)。这种易化与使用相同刺激参数的场记录中观察到的总体PPD形成对比(对照:n=7;图4B)。PreCaT PPF对改变传递PPR的药理学操作不敏感。事实上,应用高[Ca²⁺] aCSF(4 mM)本身增强了单脉冲诱发的PreCaT幅度(应用后20分钟为177.8±7.9%,n=4),但与对照条件相比对PreCaT PPF无影响(在20 ms IPI时为2.6±0.1 PreCaT2/PreCaT1,n=4;IPI×处理交互作用:F10,90=1.15,P=0.34;图4A)。相比之下,应用4 mM Ca²⁺对PS幅度无影响(应用后20分钟为97.2±5.1 mV,n=5),但在4 mM Ca²⁺中几个短IPIs处PS幅度的PPD增强(n=5;IPI×处理交互作用:F10,100=17.18,P<0.0001;IPI 20、40、80和120 ms:P<0.05;图4B)。浴应用ω-芋螺毒素GVIA(1 μM)和ω-aga毒素IVA(200 nM)混合物后的PreCaT PPF在所有测试的IPIs处也与对照无区别(在20 ms IPI时为2.8±0.1 PreCaT2/PreCaT1,n=4;IPI×处理交互作用:F10,90=0.49,P=0.89;图4A)。ryanodine(20 μM)预防内Ca²⁺储存的Ca²⁺诱导Ca²⁺释放(CICR)不改变单脉冲诱发的皮质纹状体PreCaTs(应用后20分钟为97.5±13.4%,n=4)或所有测试IPIs处的PreCaT PPF(在20 ms IPI时为2.5±0.1 PreCaT2/PreCaT1,n=4;IPI×处理交互作用:F10,90=0.98,P=0.47;图4A)。
图4. 皮质纹状体PreCaTs和传递的双脉冲比率
由间隔10、20、40、80、120、200、400、800、3000和6000 ms(IPIs以对数刻度显示)的双电脉冲诱发的两个PreCaTs(PreCaT2/PreCaT1)(A)或两个群体峰电位(PS2/PS1)(B)的比率。A, 相对于对照条件,评估CaCl₂、ω-芋螺毒素GVIA(CNTX)与ω-aga毒素IVA(AGTX)以及ryanodine对PreCaT PPR的影响。在大多数测试的IPIs中,对成对电脉冲中第二个脉冲响应的诱发PreCaT幅度相对于单个脉冲诱发的PreCaT幅度显著增强(即PreCaT幅度的PPF,绿色圆圈,n=7)。在高[Ca²⁺] aCSF(4 mM CaCl₂;蓝色正方形,n=4)存在下、联合应用ω-芋螺毒素GVIA和ω-aga毒素IVA(1 μM和200 nM;红色三角形,n=4)后或应用ryanodine(20 μM;白色菱形,n=4)后的PPF与对照条件(绿色圆圈,n=7)无区别。下方显示对照PreCaTs在单脉冲和双脉冲刺激响应下(左)及减去相应单脉冲响应后(右)的代表性轨迹(每个IPI的四个诱发反应平均值)。轨迹比例尺,1% ΔF/F,0.5 s。B, 相对于对照条件,评估CaCl₂对PS PPR的影响。在大多数测试的IPIs中,对成对电脉冲中第二个脉冲响应的诱发PS幅度相对于个脉冲诱发的PS幅度抑制(即PS幅度的PPD,橙色三角形,n=7)。在高[Ca²⁺] aCSF(4 mM CaCl₂;蓝色正方形,n=5)存在下,20、40、80和120 ms IPIs处的PPD相对于对照条件(橙色三角形,n=7)增强。下方显示对照场记录在单脉冲和双脉冲刺激响应下的代表性轨迹(每个IPI的两个诱发反应平均值)。轨迹比例尺,0.5 mV,10 ms。
04. GABAB和mGlu2/3受体介导的皮质纹状体PreCaTs和传递抑制
我们接下来测试突触前Gi/o蛋白偶联GABAB和mGlu2/3受体是否通过抑制突触前Ca²⁺内流来抑制皮质纹状体传递。浴应用GABAB受体激动剂巴氯芬(10 μM)5分钟后,PreCaT幅度降至基线的79.9±2.4%(n=5,P<0.05),PS幅度降至基线的43.7±11.1%(n=6,P<0.005)(图5A)。这种抑制在从浴中移除巴氯芬后不久逆转;停止应用巴氯芬45分钟后,PreCaT和PS幅度与基线无区别(PreCaT:基线的96.2±3.3%,n=5,与基线相比P=0.50;PS:基线的94.7±2.4%,n=6,与基线相比P=0.07)(图5A)。预先应用选择性GABAB受体拮抗剂CGP55845(2 μM)可阻断巴氯芬诱导的PreCaTs(在t=20分钟时为基线的98.6±2.1%,n=5,与基线相比P=0.74,与巴氯芬相比P<0.005)和PSs(在t=20分钟时为基线的103.6±4.1%,n=5,与基线相比P=0.51,与巴氯芬相比P<0.005)的短期抑制(图5B)。单独应用CGP55845(2 μM)对PS幅度无影响(应用后45分钟时为基线的100.8±4.2%,n=3,P=0.87;数据未显示)。这些结果表明,GABAB受体介导的皮质纹状体传递短期抑制涉及突触前Ca²⁺内流的抑制。
图5. GABAB和mGlu2/3受体介导的皮质纹状体PreCaTs和传递抑制
巴氯芬、DCG-IV和LY379268对DLS中电刺激诱发的PreCaT(∆F/F)和场电位(PS Amp)记录的影响时程。阴影区域对应药物应用时期。每张图下方显示PreCaT(左,四个诱发反应平均值)和场电位记录(右,八个诱发反应平均值)的代表性轨迹。A, 浴应用GABAB受体激动剂巴氯芬(10 μM)5分钟短暂抑制PreCaT和PS幅度。B, 预先应用GABAB受体拮抗剂CGP55845(2 μM)可防止巴氯芬(10 μM)诱导的PreCaT和PS幅度抑制。C, 浴应用mGlu2/3受体激动剂DCG-IV(1 μM)10分钟抑制PreCaT和PS幅度。D, 浴应用mGlu2/3受体激动剂LY379268(200 nM)5分钟抑制PreCaT和PS幅度。E, 预先应用mGlu2/3受体拮抗剂LY341495(500 nM)可防止LY379268(200 nM)诱导的PreCaT和PS幅度抑制。F, 浴应用LY341495(500 nM)30分钟逆转LY379268(200 nM)诱导的PreCaT和PS幅度抑制。轨迹时间点:绿色/橙色,10分钟;灰色,20分钟(A),22分钟(C),30分钟(F);黑色,60分钟。轨迹比例尺:PreCaTs,1% ΔF/F,0.5 s;场电位:0.5 mV,1 ms。
浴应用II组mGlu受体激动剂DCG-IV(1 μM)10分钟强烈抑制PreCaT幅度(在t=60分钟时为基线的75.1±5.8%,n=5,P<0.05)(图5C)。DCG-IV诱导的PS幅度抑制在10分钟应用结束时最为明显,但在停止应用DCG-IV后至少40分钟仍强烈抑制(在t=60分钟时为基线的45.1±11.8%,n=6,P<0.01)(图5C)。类似地,应用更有效和选择性的mGlu2/3受体激动剂LY379268(200 nM)5分钟强烈抑制PreCaTs(在t=60分钟时为基线的72.3±3%,n=7,P<0.0005)和PSs(在t=60分钟时为基线的50.2±6.7%,n=8,P<0.0001)(图5D)。
预先应用选择性mGlu2/3拮抗剂LY341495(500 nM)可阻断LY379268诱导的PreCaTs(在t=60分钟时为基线的94.6±2.4%,n=4,与基线相比P=0.13,与LY379268相比P<0.001)和PSs(在t=60分钟时为基线的93.1±4.5%,n=7,与基线相比P=0.26,与LY379268相比P<0.0005)的抑制(图5E)。有趣的是,LY341495还逆转了LY379268诱导的持久抑制。具体而言,在激动剂应用后30分钟,PreCaT幅度降至基线的79.8±2.6%,随后应用LY341495 30分钟后恢复至接近基线水平(在t=60分钟时为基线的94.5±3.4%,n=4,与基线相比P=0.21,与LY379268相比P<0.005)。类似地,LY379268诱导的PS幅度在30分钟时抑制至基线的60.9±5.3%,被LY341495完全逆转(在t=60分钟时为基线的97.7±3.6%,n=7,与基线相比P=0.23,与LY379268相比P<0.0001)(图5F)。单独应用LY341495对PS幅度无影响(应用后45分钟时为基线的97.3±5.6%,n=3,P=0.88;数据未显示)。这些结果表明,mGlu2/3受体的激活在皮质纹状体突触诱导一种不稳定的长时抑制(LTD;相关研究),涉及突触前Ca²⁺内流的减少。
05. P/Q型VGCC对mGlu2/3受体介导的抑制的贡献
鉴于mGlu2/3受体激活对突触前Ca²⁺的明显影响,我们接下来进行了一系列 occlusion实验,以测试选择性VGCC的阻断是否会干扰mGlu2/3受体功能。我们首先在浴应用N型VGCC阻滞剂ω-芋螺毒素GVIA后应用LY379268(图6A)。浴应用ω-芋螺毒素20分钟将PreCaT幅度降至基线的73.1±5.5%(n=4)。随后应用LY379268在40分钟后进一步将PreCaTs抑制至基线的54.8±5.5%。ω-芋螺毒素后LY379268的这种抑制与单独应用LY379268时观察到的抑制无显著差异(在65-70分钟时为25-30分钟ω-芋螺毒素基线的74.2±3.3%,与ω-芋螺毒素基线相比P<0.005,与LY379268相比P=0.93)(图6C)。我们观察到ω-芋螺毒素对LY379268诱导的PS幅度抑制也有类似的无影响(图6A)。预先应用ω-芋螺毒素将PS幅度降至基线的59.4±9.7%(n=6)后,LY379268在40分钟后进一步将PS幅度抑制至基线的28.7±10.5%。同样,N型VGCC阻断后LY379268的这种抑制与单独应用LY379268后观察到的抑制无差异(为25-30分钟ω-芋螺毒素基线的39.5±10.9%,与ω-芋螺毒素基线相比P<0.0005,与LY379268相比P=0.46)(图6C)。这些结果共同表明,皮质纹状体突触处mGlu2/3受体介导的抑制可独立于N型VGCC功能发生。
图6. P/Q型VGCC对mGlu2/3受体介导的抑制的贡献
A和B, ω-芋螺毒素GVIA(CNTX)或ω-aga毒素IVA(AGTX)对LY379268诱导的DLS中电刺激诱发的PreCaT(∆F/F)和场电位(PS Amp)记录抑制的影响时程。阴影区域对应药物应用时期。虚线表示VGCC阻滞剂应用终止时达到的平均基线∆F/F百分比(绿线)和PS Amp百分比(橙线);这些值作为后续LY379268应用效果比较的基线。每张图下方显示PreCaT(左,四个诱发反应平均值)和场电位记录(右,八个诱发反应平均值)的代表性轨迹。A, 预先应用N型VGCC阻滞剂ω-芋螺毒素GVIA(1 μM)20分钟对LY379268(200 nM)诱导的PreCaT和PS幅度抑制无影响。B, 预先应用P/Q型VGCC阻滞剂ω-aga毒素IVA(200 nM)20分钟减弱LY379268(200 nM)诱导的PS幅度抑制。预先应用ω-aga毒素IVA对LY379268诱导的PreCaT幅度抑制无改变。轨迹时间点:绿色/橙色,10分钟;灰色,30分钟;黑色,70分钟。轨迹比例尺:PreCaTs,1% ΔF/F,0.5 s;场电位:0.5 mV,1 ms。C, 有或无VGCC阻滞剂预先应用时LY379268诱导的PreCaT和PS幅度抑制总结。P/Q型VGCC阻断后(Post AGTX)LY379268对PS幅度的抑制显著小于单独LY379268(Control)观察到的抑制;*P<0.05。
相比之下,平行的一系列occlusion实验揭示了P/Q型VGCC在DLS中mGlu2/3受体功能中的作用。浴应用P/Q型VGCC阻滞剂ω-aga毒素IVA非显著地将PreCaT幅度降至基线的91.9±4.8%(n=6,P=0.49),随后应用LY379268进一步降至70.3±5.5%(P<0.01,图6B)。ω-aga毒素后LY379268的这种抑制与单独应用LY379268时观察到的抑制无显著差异(为25-30分钟ω-aga毒素基线的78.5±4.2%,与ω-aga毒素基线相比P<0.01,与LY379268相比P=0.51)(图6C)。然而,预先应用ω-aga毒素确实改变了LY379268诱导的PS幅度抑制(图6B)。应用ω-aga毒素将PS幅度降至基线的84.8±4.4%(n=8)后,LY379268在40分钟后仅进一步将PS幅度抑制至基线的65.5±8.9%。与单独应用LY379268后观察到的抑制相比,P/Q型VGCC阻断后LY379268的这种抑制显著减弱(为25-30分钟ω-aga毒素基线的75.3±8.7%,与ω-aga毒素基线相比P<0.05,与LY379268相比P<0.05)(图6C)。这些结果共同表明,皮质纹状体突触处完整的mGlu2/3受体介导的抑制需要功能性P/Q型VGCC。
四、讨论
在这里,我们开发并验证了一种使用基因编码钙指示剂GCaMP6评估背外侧纹状体(DLS)皮质输入中突触前Ca²⁺的新方法。通过同步光度法PreCaT和电生理场记录,我们发现:(1)诱发的运动皮层输入到DLS的突触前Ca²⁺内流,与DLS中的兴奋性传递类似,相对于P/Q型VGCC,优先由N型VGCC控制;(2)GABAB和mGlu2/3受体激活抑制皮质纹状体输入到DLS的突触前Ca²⁺内流;(3)mGlu2/3受体介导的抑制涉及P/Q型VGCC。这些发现揭示了自身受体和异受体对皮质纹状体功能的新型突触前调控机制,可能参与纹状体依赖性学习和动作控制。
多种因素延缓了脑片中可行的皮质纹状体突触前Ca²⁺测量方法的发展。与许多海马和小脑投射不同,皮质纹状体投射不适合突触前加载传统Ca²⁺指示剂染料,因为投射到纹状体的锥体细胞广泛分布于皮层,局部皮层区域支配多个纹状体亚区,且皮质纹状体轴突呈多平面分布。皮质纹状体突触小体也比许多经典用于研究突触前Ca²⁺功能的神经末梢小,使得单个皮质纹状体末端的高分辨率Ca²⁺成像在技术上具有挑战性。通过将现代病毒、光遗传学和转基因工具与传统基于光电倍增管的荧光检测相结合,我们开发了一种方法,能够对遗传和区域指定的皮质纹状体输入中的突触前Ca²⁺动态进行敏感且高时间分辨率的评估。
我们的工作提供了直接证据,表明GABAB和mGlu2/3受体通过抑制皮质纹状体投射中的突触前Ca²⁺内流来抑制诱发的皮质纹状体传递。这些发现与GABAB和mGlu2/3受体介导的其他中枢突触突触前Ca²⁺抑制的报道一致,并扩展了以往依赖VGCC阻滞剂探究GABAB和mGlu2/3受体机制的皮质纹状体突触研究。例如,有研究表明,ω-aga毒素TK对Q型VGCC的阻断会阻碍GABAB激动剂巴氯芬增强纹状体场电位双脉冲比率(PPRs)的能力。类似地,伏隔核(NAc)中mGlu2/3受体介导的兴奋性传递长时抑制(LTD)被证明会与ω-aga毒素IVA的抑制作用相互阻碍。我们表明,这些相同的通道对于DLS中正常的mGlu2/3受体介导的可塑性是必需的,DLS是一个输入、输出和功能与NAc不同的纹状体亚区。这些数据共同强烈支持P/Q型VGCC在代谢型谷氨酸和GABA受体对皮质纹状体突触的调节中的作用。
P/Q型VGCC阻断减少但未消除mGlu2/3受体介导的传递抑制。mGlu2/3受体的P/Q不敏感作用与背侧纹状体内外mGlu2/3(和GABAB)受体介导的神经递质释放抑制的Ca²⁺非依赖性机制的报道一致。值得注意的是,单独应用ω-aga毒素IVA诱导的抑制程度与预先应用ω-aga毒素减弱mGlu2/3受体介导的抑制的程度(约基线的20%)非常相似。
与传递不同,mGlu2/3受体介导的PreCaT幅度抑制不受先前P/Q型VGCC阻断的影响。这一观察结果可能有几种解释。例如,众所周知,鉴于递质释放与突触前Ca²⁺内流之间的约四次方关系,突触前Ca²⁺电流的小变化会对传递产生大影响。因此,本研究中药物诱导的基线PreCaT幅度百分比降低始终小于相关的PS幅度降低。因此,PS幅度的小变化可能伴随太小而无法检测到的PreCaT变化。事实上,单独应用ω-aga毒素IVA导致PS幅度降低15–20%,而PreCaT幅度无显著降低。同样,用ω-aga毒素预处理可使LY379268诱导的PS幅度降低约20%,但不太可能导致LY379268诱导的PreCaT幅度降低发生显著变化。
场光度法在研究突触前Ca²⁺的调节方面具有许多优势,包括高检测灵敏度和实时测量的频率响应、低噪声、成本低以及适用于从多种神经元输入进行光学记录。然而,其主要缺点是空间分辨率有限。对突触前Ca²⁺的最强调节作用可能发生在突触前末端内或附近,那里是大多数突触前VGCC和调节受体的位置。然而,使用群体水平的场光度法,这些效应是在表达高水平Ca²⁺指示剂但低水平VGCC和受体的突触前元件(即轴突)背景下测量的。因此,场光度法可能无法揭示突触前调节剂的微妙或空间受限的效应。
许多因素(包括光学记录的空间分辨率有限)可能导致突触前Ca²⁺测量与突触后活动之间的差异。尽管密切相关,但诱发的突触前Ca²⁺内流和突触后细胞放电是明显不同的事件,可以独立调节。突触前末端和突触后细胞接受不同的输入,表达独特的受体,并对局部电刺激诱发的各种递质和神经调质(如GABA、多巴胺等)有不同的反应。此外,表达Ca²⁺指示剂并因此对PreCaT信号有贡献的输入(如M1衍生的输入)可能与对诱发PSs有贡献的输入不同(并且可能是其子集)。这些不同的群体可能表现出独特的传递特性或调节机制。此外,光学记录可能受到与电记录无关的因素(如指示剂动力学和亲和力)的影响。
这些和其他因素不仅可以解释某些药物对PreCaT和PS幅度影响的时程细微差异,还可以解释我们的PreCaT记录中看到的强烈双脉冲易化(PPF)与PS记录中看到的双脉冲抑制(PPD)之间的鲜明对比。鉴于改变传递PPR的细胞外Ca²⁺和VGCC功能操作对PreCaT PPF无影响,且产生PreCaT PPF的确切刺激参数导致PS幅度的PPD,PreCaT PPF不太可能代表在两个紧密配对的刺激中第二个刺激期间突触前VGCC的电导增强(从而Ca²⁺内流增加)。相反,PreCaT PPF更可能归因于表达高水平GCaMP6s(一种具有相对高Ca²⁺亲和力(Kd≈144 nM)的GECI)的皮质纹状体突触前元件内的Ca²⁺缓冲。值得注意的是,PS不是突触传递的直接测量,并且受到影响神经元兴奋性的因素的影响。事实上,在短IPIs时PS中观察到的大PPD在纹状体神经元中测量兴奋性突触后电流时并未观察到。总体而言,我们的发现表明,使用这些基于场的测量方法测量PPR存在局限性,在这种情况下更好依赖突触反应的直接测量。
总之,背侧纹状体的皮质输入对于自主动作的控制至关重要,这些输入的调节是我们选择和塑造适应性行为模式能力的基础。我们的工作为皮质纹状体功能的两种主要调节控制来源的作用提供了机制见解。我们评估支配DLS的皮质纹状体投射中突触前Ca²⁺的方法可以很容易地应用于研究这些突触上的其他GPCR神经调质和活动诱导的可塑性形式,并适用于探测相关的皮质-基底神经节环路(如前额叶皮层输入到背内侧纹状体或NAc)。随着针对其他信号分子的新荧光传感器的不断推出,类似的荧光光度法方法将被证明对于更深入地理解可塑性机制具有重要价值。鉴于GABAB和mGlu2/3受体在物质滥用和亨廷顿病等基底神经节疾病中的新证据,我们的工作也为使用可能影响皮质纹状体信号传导过程的疾病模型的研究提供了基础。
东莞市富临塑胶原料有限公司是 Microprobes 在中国的代理商,为亚洲客户提供金属微电极、多通道阵列、外周电极 和 技术协助
公司地址:广东省东莞市樟木头镇塑金国际1号楼810